Ung thư đã và đang trở thành một trong những thách thức y tế lớn nhất mà nhân loại phải đối mặt trong thế kỷ 21. Tại Việt Nam, con số thống kê cho thấy hơn 180.000 ca mắc mới và 122.000 ca tử vong do ung thư được ghi nhận vào năm 2024. Hiểu rõ cơ chế gây bệnh ung thư không chỉ giúp chúng ta nhận thức được tầm nghiêm trọng của căn bệnh này, mà còn mở ra những hướng tiếp cận khoa học trong phòng ngừa và điều trị sớm.
Nội dung bài viết
- Tổng Quan Cơ Chế Gây Bệnh Ung Thư - Từ Tế Bào Bình Thường Đến Tế Bào Ung Thư
- Cơ Chế Phân Tử và Genetik Trong Phát Triển Ung Thư
- Yếu Tố Nguy Cơ và Tác Nhân Gây Ung Thư
- Cơ Chế Metastasis và Tiến Triển Ung Thư
- Phương Pháp Phát Hiện Sớm Dựa Trên Hiểu Biết Cơ Chế
- Xu Hướng Nghiên Cứu và Điều Trị Tương Lai
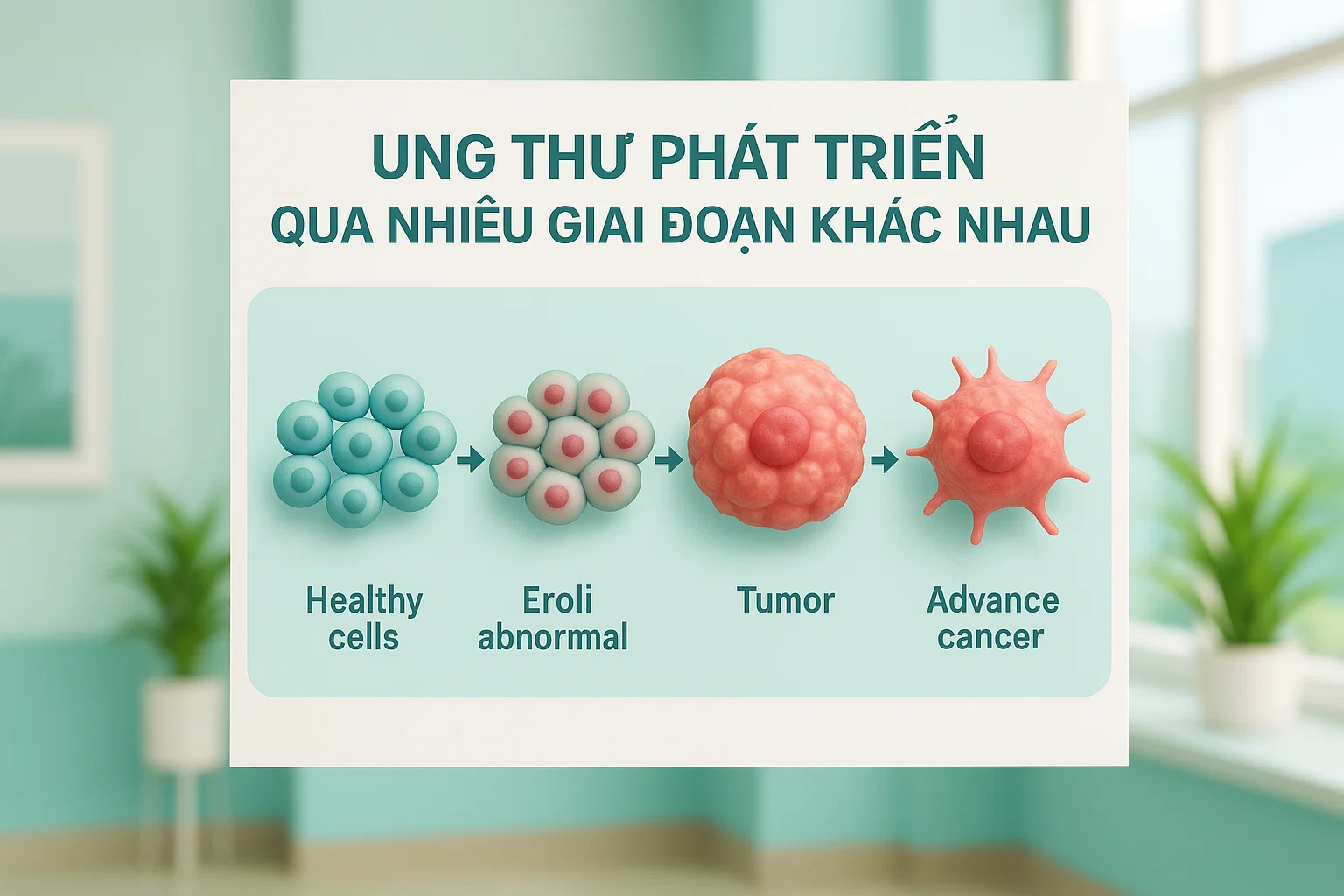
Cơ chế gây bệnh ung thư là một quá trình phức tạp diễn ra trong nhiều năm, thậm chí hàng thập kỷ. Từ một tế bào bình thường, qua hàng loạt biến đổi gen và protein, cuối cùng hình thành nên khối u ác tính có khả năng xâm lấn và di căn. Quá trình này không xảy ra ngẫu nhiên mà tuân theo những quy luật sinh học rõ ràng, có thể dự đoán và can thiệp được.
Tổng Quan Cơ Chế Gây Bệnh Ung Thư - Từ Tế Bào Bình Thường Đến Tế Bào Ung Thư
Định Nghĩa Cơ Chế Gây Bệnh Ung Thư Theo Y Khoa Hiện Đại
Theo định nghĩa của Tổ chức Y tế Thế giới (WHO), cơ chế gây bệnh ung thư hay carcinogenesis là quá trình chuyển đổi tế bào bình thường thành tế bão ung thư thông qua một chuỗi các biến đổi di truyền và biểu sinh. Quá trình oncogenesis này bao gồm sự tích lũy các đột biến trong DNA, dẫn đến mất kiểm soát chu kỳ tế bào và khả năng tự hủy của tế bào.
Tế bào ung thư khác biệt hoàn toàn với tế bào bình thường ở nhiều khía cạnh. Trong khi tế bào bình thường có chu kỳ sống có giới hạn và tuân theo tín hiệu kiểm soát từ môi trường xung quanh, tế bào ung thư lại có khả năng tự tái tạo vô hạn và không phản ứng với các tín hiệu dừng phân chia. Chúng có thể sản xuất các yếu tố tăng trưởng riêng, kháng lại tín hiệu chết tế bào lập trình và thay đổi quá trình chuyển hóa để phục vụ cho sự phát triển nhanh chóng.
Tại Việt Nam năm 2025, thống kê cho thấy các loại ung thư phổ biến nhất theo thứ tự là ung thư phổi (23.4% tổng số ca mắc mới), ung thư gan (18.2%), ung thư dạ dày (12.8%), ung thư vú (11.5%) và ung thư đại trực tràng (9.7%). Con số này phản ánh mối liên quan chặt chẽ giữa cơ chế gây bệnh ung thư với các yếu tố môi trường và lối sống đặc trưng của người Việt Nam.
Quá Trình Chuyển Đổi Tế Bào: 3 Giai Đoạn Chính
Cơ chế gây bệnh ung thư được chia thành ba giai đoạn rõ rệt, mỗi giai đoạn có những đặc điểm sinh học và thời gian phát triển khác nhau. Hiểu rõ từng giai đoạn này giúp chúng ta xác định được thời điểm can thiệp hiệu quả nhất.
Giai đoạn khởi phát (Initiation) là bước đầu tiên trong cơ chế gây bệnh ung thư, thường xảy ra rất nhanh chóng trong vòng vài giờ đến vài ngày sau khi tiếp xúc với tác nhân gây ung thư. Trong giai đoạn này, DNA của tế bào bị tổn thương bởi các tác nhân carcinogen như hóa chất, bức xạ hoặc virus. Nếu hệ thống sửa chữa DNA không khắc phục được hoàn toàn, những tổn thương này sẽ trở thành đột biến vĩnh viễn khi tế bào phân chia. Tuy nhiên, chỉ có một đột biến duy nhất chưa đủ để tạo ra tế bào ung thư.
Giai đoạn tăng trưởng (Promotion) kéo dài từ vài tháng đến nhiều năm, là giai đoạn quan trọng nhất trong cơ chế gây bệnh ung thư. Các tế bào đã bị đột biến ở giai đoạn khởi phát sẽ được kích thích phân chia mạnh mẽ bởi các tác nhân tăng trưởng (promoters). Khác với các tác nhân khởi phát, các promoters không gây đột biến trực tiếp mà tạo điều kiện thuận lợi cho tế bào đã đột biến phát triển. Ví dụ điển hình là mối quan hệ giữa nhiễm vi khuẩn Helicobacter pylori (promoter) và ung thư dạ dày, hoặc giữa hormone estrogen và ung thư vú.
Giai đoạn tiến triển (Progression) là giai đoạn cuối cùng và nguy hiểm nhất, khi tế bào ung thư có được khả năng xâm lấn và di căn. Quá trình này có thể kéo dài từ vài năm đến vài thập kỷ, tùy thuộc vào loại ung thư và đặc điểm cá thể. Trong giai đoạn này, tế bào ung thư tích lũy thêm nhiều đột biến, mất dần khả năng kiểm soát và trở nên bất tử. Chúng học cách tạo ra mạch máu nuôi dưỡng (angiogenesis), tránh được hệ miễn dịch và cuối cùng có khả năng di chuyển đến các cơ quan khác.
Timeline phát triển từ tế bào bình thường đến ung thư có thể mất từ 10-40 năm, tùy thuộc vào loại ung thư. Ung thư máu thường phát triển nhanh hơn (2-5 năm), trong khi ung thư ruột già có thể mất 20-30 năm để hình thành hoàn toàn.

Tại Sao Cần Hiểu Rõ Cơ Chế Gây Ung Thư?
Hiểu biết sâu sắc về cơ chế gây bệnh ung thư mang lại nhiều lợi ích thiết thực trong phòng ngừa và điều trị. Khi chúng ta nắm rõ quá trình carcinogenesis, có thể can thiệp vào từng giai đoạn cụ thể để ngăn chặn hoặc làm chậm sự phát triển của ung thư.
Trong phòng ngừa bậc một, hiểu biết về cơ chế gây bệnh ung thư giúp xác định và tránh các yếu tố nguy cơ từ sớm. Ví dụ, biết rằng formaldehyde là tác nhân khởi phát ung thư nasopharyngeal, chúng ta có thể hạn chế sử dụng các sản phẩm chứa chất này trong gia đình. Tương tự, hiểu được vai trò của Hepatitis B trong giai đoạn khởi phát ung thư gan giúp thúc đẩy chương trình tiêm chủng phòng bệnh.
Phòng ngừa bậc hai tập trung vào phát hiện sớm thông qua tầm soát. Khi biết rằng polyp đại tràng cần 5-10 năm để chuyển thành ung thư, chúng ta có thể thiết kế chương trình nội soi đại tràng định kỳ để phát hiện và cắt bỏ polyp trước khi chúng ác tính hóa. Đây chính là ưu điểm vượt trội của việc nắm rõ cơ chế gây bệnh ung thư trong thực hành lâm sàng.
Tại Phòng Khám Đa Khoa Công Nghệ Cao Sài Gòn Medik, đội ngũ chuyên gia y tế luôn sẵn sàng tư vấn cá nhân hóa về nguy cơ ung thư dựa trên hiểu biết khoa học về cơ chế bệnh sinh. Với trang thiết bị chẩn đoán hình ảnh hiện đại và xét nghiệm phân tử tiên tiến, chúng tôi có thể đánh giá nguy cơ và đưa ra lộ trình tầm soát phù hợp cho từng cá nhân.
Cơ Chế Phân Tử và Genetik Trong Phát Triển Ung Thư
Vai Trò Của DNA và Đột Biến Trong Cơ Chế Ung Thư
DNA mang thông tin di truyền quy định mọi hoạt động của tế bào, từ quá trình phân chia, phát triển đến chết tế bào lập trình. Trong cơ chế gây bệnh ung thư, sự toàn vẹn của DNA đóng vai trò then chốt. Mỗi ngày, DNA trong tế bào chúng ta phải chịu hàng nghìn lần tấn công từ các gốc tự do, tia UV, hóa chất và các yếu tố khác, tạo ra khoảng 1.000-10.000 tổn thương DNA trên mỗi tế bào.
Cơ thể có hệ thống sửa chữa DNA rất hiệu quả, có thể khắc phục 99.9% các tổn thương này. Tuy nhiên, 0.1% còn lại nếu không được sửa chữa kịp thời sẽ trở thành đột biến vĩnh viễn trong cơ chế gây bệnh ung thư. Quá trình sao chép DNA diễn ra với tốc độ 750 nucleotide/giây và độ chính xác 99.999%, nhưng vẫn có thể xảy ra lỗi với tần suất 1/10^9 đến 1/10^10 trên mỗi nucleotide.
Có ba loại đột biến chính tham gia vào cơ chế gây bệnh ung thư: đột biến điểm (point mutation), đột biến chèn (insertion) và đột biến mất đoạn (deletion). Đột biến điểm là loại phổ biến nhất, xảy ra khi một nucleotide bị thay thế bằng nucleotide khác, ví dụ từ G→T hoặc A→C. Loại đột biến này có thể không gây ảnh hưởng nếu không làm thay đổi amino acid (silent mutation), hoặc có thể gây ra hậu quả nghiêm trọng nếu tạo ra protein bất thường.
Đột biến chèn và mất đoạn thường gây ảnh hưởng nghiêm trọng hơn vì chúng làm lệch khung đọc (frameshift), dẫn đến protein hoàn toàn khác với bản gốc. Trong ung thư đại trực tràng, đột biến mất đoạn tại gen APC xảy ra ở 80% các trường hợp, là bước đầu tiên trong cơ chế gây bệnh ung thư loại này.
Tích lũy đột biến là đặc điểm quan trọng của cơ chế gây bệnh ung thư. Theo mô hình "multiple hits", một tế bào cần tích lũy từ 6-10 đột biến ở các gen quan trọng mới có thể chuyển thành tế bào ung thư. Điều này giải thích tại sao ung thư thường xuất hiện ở tuổi cao, khi có đủ thời gian để tích lũy đột biến. Tuy nhiên, ở một số trường hợp hiếm gặp, các đột biến di truyền có thể làm giảm đáng kể thời gian cần thiết cho quá trình này.
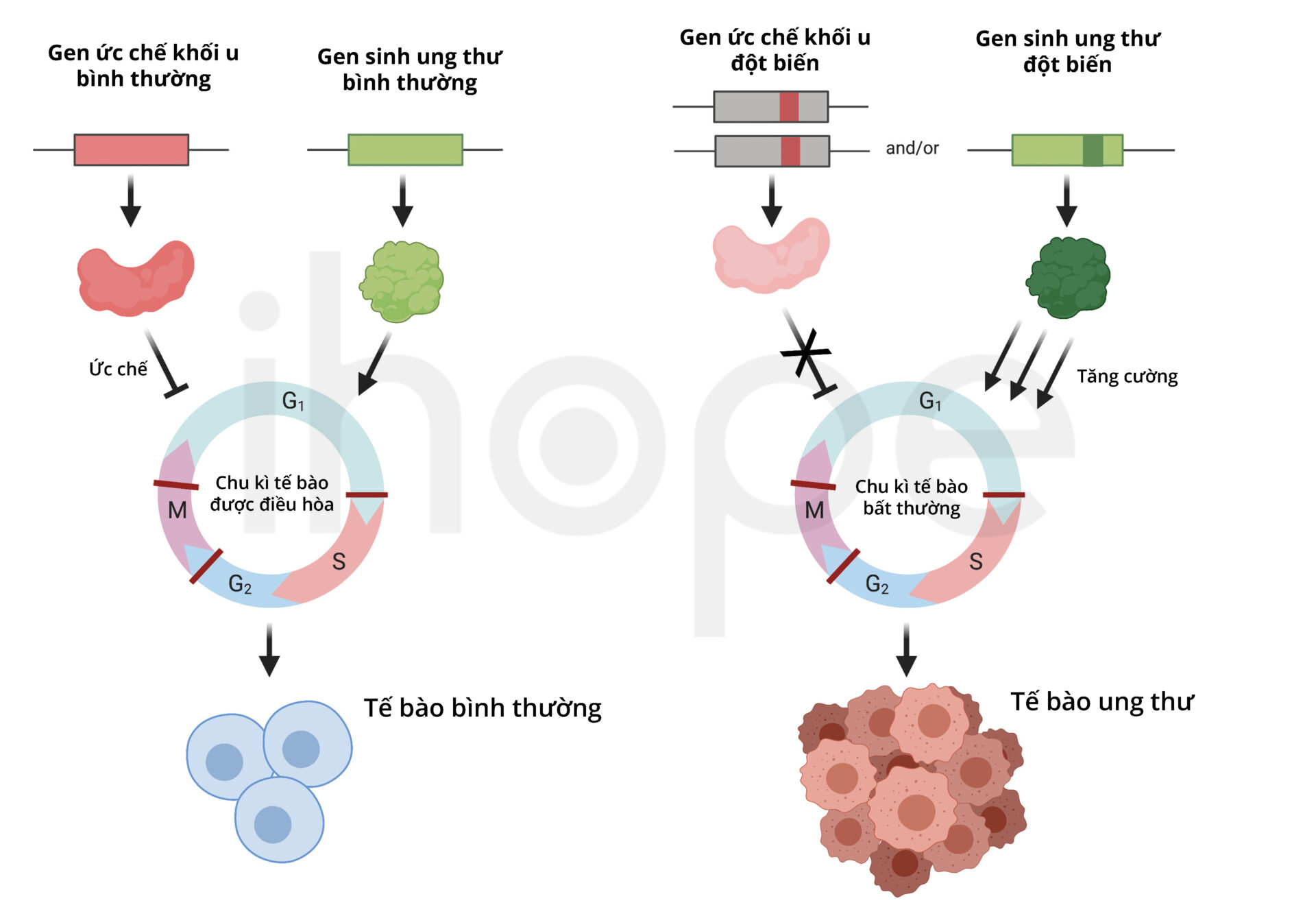
Oncogenes và Tumor Suppressor Genes - Hai Mặt Của Đồng Xu
Trong cơ chế gây bệnh ung thư, có hai nhóm gen quan trọng đóng vai trò trái ngược nhau: oncogenes (gen ung thư) và tumor suppressor genes (gen ức chế khối u). Hiểu rõ chức năng và cơ chế hoạt động của hai nhóm gen này là chìa khóa để nắm bắt bản chất của ung thư.
Oncogenes là phiên bản đột biến của các proto-oncogenes bình thường, có chức năng kích thích sự phân chia tế bào. Khi hoạt động bình thường, proto-oncogenes giúp điều hòa chu kỳ tế bào và quá trình phát triển. Tuy nhiên, khi bị đột biến hoặc biểu hiện quá mức, chúng trở thành oncogenes và thúc đẩy cơ chế gây bệnh ung thư.
Gen RAS là oncogene phổ biến nhất, bị đột biến trong 30% các loại ung thư. Protein RAS bình thường hoạt động như một công tắc phân tử, chuyển tín hiệu tăng trưởng từ bên ngoài vào bên trong tế bào. Khi bị đột biến, RAS bị "kẹt" ở trạng thái bật, liên tục gửi tín hiệu phân chia tế bào ngay cả khi không có tín hiệu kích thích từ bên ngoài. Điều này dẫn đến tăng sinh tế bào không kiểm soát, một đặc điểm chính của cơ chế gây bệnh ung thư.
Gen MYC là oncogene quan trọng khác, được tìm thấy bị khuếch đại trong nhiều loại ung thư bao gồm lymphoma, ung thư vú và ung thư đại trực tràng. MYC điều hòa biểu hiện của hàng trăm gen khác liên quan đến chu kỳ tế bào, chuyển hóa và tổng hợp protein. Khi hoạt động quá mức, MYC biến tế bào thành "máy sản xuất" không ngừng nghỉ, tiêu thụ glucose và glutamine với tốc độ gấp 10-20 lần tế bào bình thường.
HER2 (Human Epidermal Growth Factor Receptor 2) là oncogene điển hình trong ung thư vú, bị khuếch đại trong 15-20% ca bệnh. Khi HER2 hoạt động quá mức, tế bào ung thư vú trở nên hung hãn hơn, phát triển nhanh và có xu hướng di căn cao. Tuy nhiên, đây cũng là ví dụ tuyệt vời về cách hiểu biết cơ chế gây bệnh ung thư dẫn đến phát triển thuốc đích - Trastuzumab (Herceptin) đã cải thiện đáng kể tiên lượng của bệnh nhân.
Ngược lại, tumor suppressor genes hoạt động như "phanh" của tế bào, ngăn chặn sự phân chia không kiểm soát. Gen quan trọng nhất trong nhóm này là p53, được gọi là "người bảo vệ bộ gen" vì khả năng phát hiện tổn thương DNA và kích hoạt cơ chế sửa chữa hoặc chết tế bào lập trình. p53 bị đột biến trong hơn 50% các loại ung thư, làm mất khả năng kiểm soát chất lượng DNA trong cơ chế gây bệnh ung thư.
RB1 (Retinoblastoma gene) là tumor suppressor gene đầu tiên được phát hiện, có chức năng kiểm soát chuyển tiếp từ pha G1 sang pha S trong chu kỳ tế bào. Khi RB1 hoạt động bình thường, nó ngăn tế bào tiến vào pha tổng hợp DNA cho đến khi các điều kiện thích hợp được đáp ứng. Mất chức năng RB1 dẫn đến tế bào bỏ qua các điểm kiểm soát quan trọng, thúc đẩy cơ chế gây bệnh ung thư.
BRCA1 và BRCA2 là hai tumor suppressor genes đặc biệt quan trọng trong ung thư vú và buồng trứng di truyền. Protein do các gen này mã hóa tham gia vào quá trình sửa chữa DNA bằng tái tổ hợp tương đồng (homologous recombination). Phụ nữ mang đột biến BRCA1 có nguy cơ mắc ung thư vú lên đến 65% và ung thư buồng trứng lên đến 39% trong suốt cuộc đời.
Cơ chế "two-hit hypothesis" của Knudson giải thích cách tumor suppressor genes mất chức năng trong cơ chế gây bệnh ung thư. Theo giả thuyết này, cần có hai "hit" (đột biến hoặc mất chức năng) để vô hiệu hóa hoàn toàn một tumor suppressor gene. Hit đầu tiên có thể di truyền từ cha mẹ hoặc mắc phải trong cuộc sống, hit thứ hai thường xảy ra do các yếu tố môi trường hoặc lão hóa.
Epigenetic và Điều Hòa Gen Trong Ung Thư
Cơ chế gây bệnh ung thư không chỉ phụ thuộc vào các thay đổi trong trình tự DNA mà còn liên quan đến các biến đổi epigenetic - những thay đổi trong biểu hiện gen mà không làm thay đổi trình tự DNA. Epigenetic đóng vai trò quan trọng như một "công tắc" điều khiển việc bật/tắt các gen, và sự rối loạn trong hệ thống này góp phần đáng kể vào quá trình carcinogenesis.
DNA methylation là cơ chế epigenetic quan trọng nhất trong cơ chế gây bệnh ung thư. Quá trình này xảy ra khi nhóm methyl (-CH3) được gắn vào cytosine trong cặp nucleotide CpG (cytosine-guanine dinucleotide). Trong điều kiện bình thường, methylation giúp kiểm soát biểu hiện gen trong quá trình phát triển và duy trì sự ổn định của bộ gen. Tuy nhiên, trong ung thư, có thể xảy ra hypermethylation bất thường tại vùng promoter của tumor suppressor genes, dẫn đến tắt tiếng các gen này mà không cần đột biến.
Một ví dụ điển hình là hypermethylation của gen MLH1 trong ung thư đại trực tràng. MLH1 có chức năng sửa chữa các lỗi trong quá trình nhân đôi DNA (mismatch repair). Khi promoter của MLH1 bị hypermethylation, gen này bị tắt tiếng, dẫn đến tích lũy đột biến nhanh chóng và thúc đẩy cơ chế gây bệnh ung thư. Điều thú vị là hypermethylation MLH1 thường xảy ra ở ung thư đại trực tràng không có yếu tố di truyền, cho thấy vai trò của yếu tố môi trường trong việc điều chỉnh epigenetic.
Histone modification là cơ chế epigenetic khác có ảnh hưởng sâu sắc đến cơ chế gây bệnh ung thư. Histone là protein mà DNA quấn quanh để tạo thành cấu trúc chromatin. Các modification như acetylation, methylation, phosphorylation và ubiquitination của histone có thể làm thay đổi cấu trúc chromatin, từ đó ảnh hưởng đến khả năng tiếp cận của các yếu tố phiên mã với DNA.
Histone deacetylase (HDAC) là enzyme loại bỏ nhóm acetyl khỏi histone, thường dẫn đến condensation của chromatin và giảm biểu hiện gen. Trong nhiều loại ung thư, HDAC hoạt động quá mức, gây ra tắt tiếng của tumor suppressor genes thông qua cơ chế epigenetic. Điều này đã dẫn đến phát triển nhóm thuốc ức chế HDAC như Vorinostat và Romidepsin trong điều trị ung thư.
Ảnh hưởng của môi trường đến biểu hiện gen thông qua cơ chế epigenetic là một khía cạnh đặc biệt quan trọng của cơ chế gây bệnh ung thư. Các yếu tố như chế độ ăn uống, stress, hoạt động thể lực, tiếp xúc với hóa chất và thậm chí cả kinh nghiệm tâm lý có thể ảnh hưởng đến mô hình methylation và histone modification. Ví dụ, chế độ ăn giàu folate và vitamin B12 cung cấp nhóm methyl cho quá trình methylation, có thể bảo vệ khỏi một số loại ung thư.
Tính khả nghịch của epigenetic changes mang lại hy vọng lớn trong điều trị ung thư. Khác với đột biến DNA vĩnh viễn, các thay đổi epigenetic có thể được đảo ngược bằng thuốc. Hiện tại, FDA đã phê duyệt nhiều loại thuốc tác động lên cơ chế epigenetic như 5-azacytidine (demethylating agent) và các ức chế HDAC để điều trị một số loại ung thư máu. Điều này mở ra tiềm năng lớn trong việc phát triển các liệu pháp mới dựa trên hiểu biết về cơ chế gây bệnh ung thư ở cấp độ epigenetic.
Yếu Tố Nguy Cơ và Tác Nhân Gây Ung Thư
Tác Nhân Hóa Học và Vật Lý Gây Ung Thư
Các tác nhân carcinogen hóa học và vật lý đóng vai trò khởi phát quan trọng trong cơ chế gây bệnh ung thư. Cơ quan Nghiên cứu Ung thư Quốc tế (IARC) đã phân loại hơn 120 tác nhân được xác định là gây ung thư cho con người (Group 1), và con số này tiếp tục tăng khi có thêm bằng chứng khoa học mới.
Benzene là một trong những carcinogen hóa học được nghiên cứu kỹ lưỡng nhất, có mặt trong khí xả ôtô, khói thuốc lá và một số sản phẩm công nghiệp. Trong cơ chế gây bệnh ung thư, benzene được chuyển hóa trong gan thành phenol, catechol và hydroquinone - những metabolite có khả năng tương tác trực tiếp với DNA. Tiếp xúc mãn tính với benzene ở nồng độ > 1 ppm trong không khí có thể tăng nguy cơ ung thư máu lên 2-3 lần. Tại các khu vực có mật độ giao thông cao ở TP.HCM, nồng độ benzene trong không khí có thể đạt 15-25 μg/m³, cao hơn giới hạn khuyến cáo của WHO (5 μg/m³).
Asbestos là carcinogen đặc biệt nguy hiểm vì tính chất vật lý đặc biệt của nó. Sợi asbestos có đường kính < 3 micromet và dài > 5 micromet có thể xuyên sâu vào phế nang và tồn tại trong phổi suốt đời. Cơ chế gây ung thư phổi và mesothelioma của asbestos liên quan đến tạo ra gốc tự do, gây viêm mãn tính và tổn thương trực tiếp DNA. Thời gian tiềm ẩn từ lúc tiếp xúc đến khi phát bệnh có thể lên đến 20-50 năm, khiến cơ chế gây bệnh ung thư này đặc biệt nguy hiểm.
Formaldehyde là carcinogen phổ biến trong đời sống hàng ngày, có mặt trong keo dán gỗ, sơn, mỹ phẩm và thậm chí một số thực phẩm bảo quản. Nồng độ formaldehyde trong nhà có thể đạt 0.1-0.3 mg/m³, cao hơn nhiều so với không khí ngoài trời (0.001-0.02 mg/m³). Trong cơ chế gây bệnh ung thư nasopharyngeal, formaldehyde tạo ra DNA-protein crosslinks và DNA-DNA crosslinks, gây đứt gãy nhiễm sắc thể và đột biến gen. Nguy cơ này đặc biệt cao ở người Châu Á do yếu tố di truyền.
Bức xạ ion hóa là tác nhân vật lý mạnh nhất trong cơ chế gây bệnh ung thư. Với năng lượng > 10 eV, bức xạ ion hóa có thể tách electron khỏi nguyên tử, tạo ra ion và gốc tự do có khả năng phá hủy DNA. Mối quan hệ giữa liều bức xạ và nguy cơ ung thư tuân theo mô hình tuyến tính không ngưỡng (linear no-threshold model), có nghĩa là không có liều nào được coi là hoàn toàn an toàn. Liều bức xạ nền tự nhiên tại Việt Nam dao động từ 1.5-2.5 mSv/năm, chủ yếu từ radon trong đất và tia vũ trụ.
Tia UV từ ánh nắng mặt trời là nguyên nhân chính gây ung thư da. UV-B (280-315 nm) có năng lượng cao nhất, có thể xuyên qua lớp biểu bì và gây tổn thương trực tiếp DNA. Cơ chế chính là tạo ra thymine dimer - liên kết bất thường giữa hai thymine kế tiếp trên chuỗi DNA. Nếu không được sửa chữa, thymine dimer có thể dẫn đến đột biến C→T trong cơ chế gây bệnh ung thư da. Chỉ số UV tại Việt Nam thường ở mức "rất cao" (8-10) vào mùa hè, đòi hỏi biện pháp bảo vệ nghiêm ngặt.
Ô nhiễm không khí đã được IARC xếp vào nhóm carcinogen chắc chắn gây ung thư phổi ở con người. PM2.5 (bụi mịn có đường kính < 2.5 micromet) có khả năng xuyên sâu vào phế nang và gây viêm mãn tính. Tại TP.HCM, nồng độ PM2.5 trung bình năm 2024 là 26.8 μg/m³, cao hơn tiêu chuẩn WHO (5 μg/m³). Các hợp chất đa vòng thơm (PAH) và kim loại nặng bám trên bụi mịn có thể kích hoạt cơ chế gây bệnh ung thư thông qua tạo ra gốc tự do và gây đột biến DNA.
Tác Nhân Sinh Học: Virus, Bacteria và Parasite
Khoảng 15-20% các ca ung thư trên thế giới có liên quan đến nhiễm trùng, với tỷ lệ này cao hơn ở các nước đang phát triển như Việt Nam. Các tác nhân sinh học gây ung thư hoạt động thông qua nhiều cơ chế khác nhau trong cơ chế gây bệnh ung thư, từ gây viêm mãn tính, sản xuất toxin đến can thiệp trực tiếp vào chu kỳ tế bào.
Human Papillomavirus (HPV) là nguyên nhân của 99.7% ca ung thư cổ tử cung và nhiều loại ung thư khác ở vùng sinh dục và hầu họng. HPV type 16 và 18 chịu tr책nhiệm cho 70% ca ung thư cổ tử cung toàn cầu. Trong cơ chế gây bệnh ung thư do HPV, protein E6 và E7 của virus tương tác trực tiếp với p53 và pRb - hai tumor suppressor protein quan trọng nhất. E6 thúc đẩy degradation của p53, trong khi E7 vô hiệu hóa pRb, dẫn đến mất kiểm soát chu kỳ tế bào và tăng sinh không kiểm soát.
Tại Việt Nam, tỷ lệ nhiễm HPV ở phụ nữ trong độ tuổi sinh sản là 6.1%, trong đó HPV type 16 chiếm 1.8% và type 18 chiếm 0.4%. Vaccine HPV bivalent (Cervarix) và quadrivalent (Gardasil) đã chứng minh hiệu quả 95-100% trong phòng ngừa nhiễm HPV type 16 và 18 khi tiêm trước khi có hoạt động tình dục. Đây là ví dụ điển hình về cách hiểu biết cơ chế gây bệnh ung thư dẫn đến phát triển biện pháp phòng ngừa hiệu quả.
Hepatitis B virus (HBV) và Hepatitis C virus (HCV) là nguyên nhân chính của ung thư gan, chiếm 78% tổng số ca bệnh toàn cầu. Tại Việt Nam, tỷ lệ nhiễm HBV mãn tính ở người trưởng thành là 5.7%, trong khi HCV là 1.6%. Trong cơ chế gây bệnh ung thư gan do virus viêm gan, protein X của HBV (HBx) có khả năng ức chế p53, kích hoạt các oncogene và gây bất ổn nhiễm sắc thể. HCV gây ung thư gan chủ yếu thông qua cơ chế viêm mãn tính và xơ gan, tạo môi trường thuận lợi cho cơ chế gây bệnh ung thư.
Helicobacter pylori là vi khuẩn gây ung thư dạ dày, được IARC xếp vào nhóm carcinogen chắc chắn từ năm 1994. Tỷ lệ nhiễm H. pylori tại Việt Nam rất cao, đạt 58.3% ở người trưởng thành và 35.2% ở trẻ em. Vi khuẩn này sản xuất cytotoxin-associated gene A (CagA) - một oncoprotein có khả năng can thiệp vào nhiều đường tín hiệu tế bào. CagA được tiêm trực tiếp vào tế bào biểu mô dạ dày và hoạt động như một "Trojan horse", phá vỡ các điểm nối tế bào và kích hoạt cơ chế gây bệnh ung thư.
Epstein-Barr virus (EBV) liên quan đến ung thư nasopharyngeal, lymphoma Burkitt và một số loại ung thư khác. EBV có khả năng biến đổi tế bào B lymphocyte thành dòng tế bào bất tử thông qua biểu hiện các protein virus như LMP1 và EBNA1. Trong cơ chế gây bệnh ung thư nasopharyngeal, EBV thường hoạt động phối hợp với các yếu tố môi trường như tiêu thụ cá muối và tiếp xúc formaldehyde, tạo ra hiệu ứng hiệp đồng trong quá trình carcinogenesis.
Schistosoma haematobium là ký sinh trùng gây ung thư bàng quang, phổ biến ở Châu Phi và một số vùng Trung Đông. Trứng của ký sinh trùng này gây viêm mãn tính niêm mạc bàng quang, dẫn đến metaplasia và cuối cùng là ung thư. Cơ chế này cho thấy vai trò của viêm mãn tính trong cơ chế gây bệnh ung thư, khi hệ miễn dịch liên tục được kích hoạt sẽ tạo ra môi trường thuận lợi cho sự phát triển của tế bào ung thư.
Yếu Tố Lối Sống và Môi Trường Tại Việt Nam
Lối sống và môi trường sống có ảnh hưởng sâu sắc đến cơ chế gây bệnh ung thư, đặc biệt tại Việt Nam với những đặc điểm địa lý, khí hậu và văn hóa riêng biệt. Các yếu tố này không chỉ hoạt động như tác nhân khởi phát mà còn đóng vai trò quan trọng trong giai đoạn tăng trưởng của quá trình carcinogenesis.
Hút thuốc lá vẫn là yếu tố nguy cơ hàng đầu, chịu trách nhiệm cho 22% ca tử vong do ung thư toàn cầu. Tại Việt Nam, tỷ lệ hút thuốc ở nam giới trưởng thành là 45.3%, trong khi ở nữ giới là 1.1%. Khói thuốc lá chứa hơn 70 carcinogen được xác nhận, trong đó benzo[a]pyrene và nitrosamine là những hợp chất nguy hiểm nhất. Trong cơ chế gây bệnh ung thư phổi, các carcinogen này tạo ra DNA adduct - liên kết cộng hóa trị giữa carcinogen và DNA, dẫn đến đột biến nếu không được sửa chữa kịp thời.
Đáng chú ý, nguy cơ ung thư phổi ở người không hút thuốc nhưng sống chung với người hút thuốc tăng 20-30% do khói thuốc thụ động. Tại Việt Nam, 58.4% người không hút thuốc bị phơi nhiễm khói thuốc thụ động tại nhà và 38.7% tại nơi làm việc. Con số này phản ánh tầm quan trọng của việc kiểm soát thuốc lá trong phòng ngừa ung thư ở cấp độ cộng đồng.
Sử dụng rượu bia là yếu tố nguy cơ quan trọng khác trong cơ chế gây bệnh ung thư, đặc biệt ở các cơ quan tiếp xúc trực tiếp như miệng, họng, thực quản và gan. Mức tiêu thụ rượu bình quân đầu người tại Việt Nam là 8.3 lít/năm (tính theo ethanol nguyên chất), cao hơn mức trung bình Đông Nam Á (4.7 lít/năm). Ethanol được chuyển hóa thành acetaldehyde - một carcinogen mạnh có khả năng tạo ra DNA adduct và gây đứt gãy nhiễm sắc thể.
Cơ chế synergistic giữa rượu và thuốc lá đặc biệt nguy hiểm. Rượu có thể tăng hấp thu các carcinogen trong khói thuốc và ức chế enzyme sửa chữa DNA, làm tăng nguy cơ ung thư đầu cổ lên 35 lần ở người vừa hút thuốc vừa uống rượu nhiều so với người không có thói quen nào.
Chế độ ăn uống đóng vai trò phức tạp trong cơ chế gây bệnh ung thư. Thực phẩm chế biến sẵn như xúc xích, thịt hun khói chứa nitrite và nitrate, có thể chuyển thành N-nitrosamine - carcinogen mạnh trong điều kiện acid của dạ dày. Tiêu thụ 50g thịt chế biến sẵn mỗi ngày tăng nguy cơ ung thư đại trực tràng 18%. Tại Việt Nam, các món ăn truyền thống như chả lụa, giò thủ, nem chua chứa lượng nitrite cao (100-200 mg/kg), vượt quá khuyến cáo an toàn.
Cá muối, đặc sản của miền Bắc Việt Nam, chứa dimethylnitrosamine và diethylnitrosamine - hai carcinogen được xác định gây ung thư nasopharyngeal. Nghiên cứu tại Việt Nam cho thấy tiêu thụ cá muối ≥ 1 lần/tuần trong thời thơ ấu tăng nguy cơ ung thư nasopharyngeal 2.1 lần. Cơ chế này liên quan đến việc niêm mạc mũi họng ở trẻ em còn non nớt, dễ bị tổn thương bởi carcinogen.
Yếu tố nghề nghiệp cũng góp phần quan trọng vào cơ chế gây bệnh ung thư tại Việt Nam. Công nhân xây dựng tiếp xúc với asbestos, bụi silica và các hóa chất công nghiệp. Nông dân sử dụng thuốc trừ sâu như organochlorine và organophosphate có nguy cơ cao mắc lymphoma non-Hodgkin và ung thư não. Thợ hàn tiếp xúc với khói kim loại chứa chromium VI, nickel và cadmium - những kim loại nặng được IARC xếp vào nhóm carcinogen chắc chắn.
Đặc biệt, công nhân trong ngành giày da và dệt may - hai ngành công nghiệp lớn của Việt Nam - thường xuyên tiếp xúc với benzene, toluene, formaldehyde và các hóa chất nhuộm. Nghiên cứu tại các khu công nghiệp phía Nam cho thấy nồng độ benzene trong không khí nhà xưởng có thể đạt 2-5 lần giới hạn cho phép, tạo nguy cơ cao cho cơ chế gây bệnh ung thư máu ở công nhân.
Cơ Chế Metastasis và Tiến Triển Ung Thư
Quá Trình Metastasis: Từ Tế Bào Đến Cơ Quan Xa
Metastasis - quá trình di căn - là đặc điểm định nghĩa và nguy hiểm nhất của ung thư, chịu trách nhiệm cho 90% ca tử vong do ung thư. Trong cơ chế gây bệnh ung thư, metastasis không phải là sự kiện ngẫu nhiên mà là một quá trình có tổ chức, bao gồm nhiều bước tuần tự mà tế bào ung thư phải vượt qua để thành công di căn đến cơ quan xa.
Bước đầu tiên trong cascade metastasis là quá trình epithelial-mesenchymal transition (EMT). Tế bào ung thư biểu mô phải mất đi các đặc tính gắn kết chặt chẽ với nhau và môi trường xung quanh, đồng thời có được khả năng di chuyển. Trong cơ chế gây bệnh ung thư, EMT được điều khiển bởi các yếu tố phiên mã như Snail, Slug, Twist và ZEB1. Các protein này ức chế biểu hiện E-cadherin - protein quan trọng nhất trong việc duy trì adherens junction giữa các tế bào biểu mô, đồng thời tăng biểu hiện N-cadherin và vimentin để tạo ra kiểu hình mesenchymal.
Quá trình EMT không chỉ đơn thuần thay đổi hình thái tế bào mà còn tái lập trình toàn bộ chương trình biểu hiện gen. Tế bào ung thư trở nên kháng thuốc hóa trị, kháng apoptosis và có khả năng tự tái tạo như tế bào gốc ung thư. Nghiên cứu cho thấy các tế bào đã trải qua EMT có biểu hiện cao các marker của tế bào gốc như CD44, CD133 và ALDH1, giải thích tại sao chúng có khả năng khởi tạo khối u thứ phát ở cơ quan di căn.
Invasion là bước tiếp theo, khi tế bào ung thư phải phá vỡ basement membrane và xâm lấn vào stroma xung quanh. Matrix metalloproteinases (MMPs) đóng vai trò chìa khóa trong quá trình này. MMP-2 và MMP-9 có khả năng phân hủy collagen type IV - thành phần chính của basement membrane, tạo ra "đường hầm" cho tế bào ung thư xâm lấn. Trong cơ chế gây bệnh ung thư, hoạt tính của MMPs được điều hòa chặt chẽ bởi các tissue inhibitors of metalloproteinases (TIMPs). Mất cân bằng MMP/TIMP dẫn đến quá trình remodeling ECM không kiểm soát, thuận lợi cho invasion.
Intravasation - quá trình tế bào ung thư xâm nhập vào lòng mạch máu hoặc mạch lympho - là thách thức lớn tiếp theo. Chỉ có khoảng 0.01% tế bào ung thư có thể vượt qua được rào cản nội mô mạch máu. Tế bào ung thư phải tương tác với pericyte và basement membrane của mạch máu, đồng thời kháng lại các lực cắt do dòng chảy máu gây ra. VEGF-A (Vascular Endothelial Growth Factor-A) không chỉ kích thích angiogenesis mà còn tăng tính thấm mạch máu, tạo điều kiện thuận lợi cho intravasation.
Giai đoạn circulation là thử thách sinh tồn khắc nghiệt nhất đối với tế bào ung thư. Trong máu, chúng phải chịu anoikis - dạng apoptosis xảy ra khi tế bào mất liên kết với ECM, chịu tấn công từ hệ miễn dịch và chống lại các lực cơ học từ dòng máu. Nghiên cứu cho thấy chỉ có 0.1% circulating tumor cells (CTCs) có thể sống sót sau 24 giờ trong máu. Các tế bào sống sót thường tạo thành cluster với tiểu cầu và neutrophil, tạo ra "lá chắn" bảo vệ khỏi hệ miễn dịch và các lực cơ học.
Extravasation - quá trình tế bào ung thư thoát khỏi lòng mạch máu tại cơ quan đích - diễn ra thông qua cơ chế tương tự nhưng ngược lại với intravasation. Tế bào ung thư phải dính vào endothelium, phá vỡ tight junction giữa các tế bào nội mô và xuyên qua basement membrane. Selectin và integrin đóng vai trò quan trọng trong adhesion ban đầu, trong khi MMPs tiếp tục phát huy chức năng phân hủy ECM.
Angiogenesis - Hình Thành Mạch Máu Nuôi Khối U
Angiogenesis - quá trình hình thành mạch máu mới - là điều kiện tiên quyết cho sự phát triển của khối u và metastasis. Trong cơ chế gây bệnh ung thư, khối u không thể phát triển vượt quá 1-2 mm³ (khoảng 10^6 tế bào) nếu không có cung cấp máu mới. Tại điểm này, tế bào ung thư ở trung tâm khối u bắt đầu chịu thiếu oxy (hypoxia) và thiếu dinh dưỡng, buộc phải kích hoạt "angiogenic switch" để sinh tồn.
Hypoxia-inducible factor 1α (HIF-1α) là điều hòa viên chính của angiogenesis trong điều kiện thiếu oxy. Khi nồng độ oxy giảm xuống dưới 2% (so với 21% trong không khí), HIF-1α được ổn định và di chuyển vào nhân để kích hoạt biểu hiện hàng trăm gen đáp ứng với thiếu oxy. VEGF-A là target gene quan trọng nhất của HIF-1α, có khả năng kích thích sự phân chia và di chuyển của tế bào nội mô mạch máu.
VEGF signaling pathway hoạt động thông qua các receptor tyrosine kinase VEGFR-1, VEGFR-2 và VEGFR-3. VEGFR-2 là receptor chính cho angiogenesis, khi được kích hoạt sẽ dẫn đến phosphorylation của nhiều protein downstream như PLCγ, Akt và ERK1/2. Cascade tín hiệu này thúc đẩy tế bào nội mô tăng sinh, di chuyển, sống sót và hình thành lumen mạch máu. Trong cơ chế gây bệnh ung thư, VEGF-A cũng tăng vascular permeability bằng cách làm mất ổn định VE-cadherin junction, tạo điều kiện thuận lợi cho extravasation của tế bào ung thư.
Angiopoietin-Tie signaling là pathway quan trọng khác trong angiogenesis, chịu trách nhiệm cho vessel maturation và stabilization. Angiopoietin-1 (Ang-1) liên kết với Tie2 receptor trên tế bào nội mô để thúc đẩy tuyển dụng pericyte và smooth muscle cell, tạo ra mạch máu trưởng thành và ổn định. Ngược lại, Angiopoietin-2 (Ang-2) hoạt động như antagonist của Ang-1, gây destabilization mạch máu và tạo điều kiện cho angiogenesis mới.
Tumor angiogenesis khác biệt đáng kể so với angiogenesis sinh lý bình thường. Mạch máu trong khối u thường có cấu trúc bất thường với lumen không đều, thiếu pericyte coverage và basement membrane không hoàn chỉnh. Điều này dẫn đến tình trạng "leaky vasculature" - mạch máu thấm nhiều, gây tăng áp lực kẽ và hypoxia mạn tính trong khối u. Paradoxically, chính hypoxia này lại tiếp tục kích thích angiogenesis, tạo ra vòng luẩn quẩn trong cơ chế gây bệnh ung thư.
Therapeutic angiogenesis inhibition đã trở thành một trong những hướng điều trị ung thư quan trọng. Bevacizumab (Avastin) - kháng thể đơn dòng chống VEGF-A - là thuốc đầu tiên trong nhóm này được FDA phê duyệt. Tuy nhiên, hiệu quả của anti-angiogenic therapy bị hạn chế bởi sự phát triển của drug resistance và activation của alternative angiogenic pathway. Hiện tại, chiến lược combination therapy kết hợp nhiều anti-angiogenic agent hoặc kết hợp với hóa trị/xạ trị đang được nghiên cứu để vượt qua vấn đề này.
Immune Evasion - Cơ Chế Tránh Hệ Miễn Dịch
Khả năng tránh được hệ miễn dịch (immune evasion) là một hallmark quan trọng của ung thư, cho phép tế bào ung thư sinh tồn và phát triển trong môi trường có hệ miễn dịch hoạt động. Trong cơ chế gây bệnh ung thư, sự tương tác phức tạp giữa tế bào ung thư và hệ miễn dịch được mô tả qua khái niệm "immunoediting" - một quá trình gồm ba giai đoạn: elimination, equilibrium và escape.
Giai đoạn elimination (loại bỏ) xảy ra khi hệ miễn dịch nhận diện và tiêu diệt thành công tế bào ung thư non trẻ. Trong cơ chế gây bệnh ung thư, các tế bào NK (Natural Killer), CD8+ T cell và macrophage đóng vai trò quan trọng trong giai đoạn này. Tế bào NK có khả năng nhận diện tế bào ung thư thông qua sự giảm biểu hiện MHC class I và tăng biểu hiện stress ligand như MICA/MICB. CD8+ T cell nhận diện tumor-associated antigen (TAA) được trình bày bởi MHC class I và tiết ra perforin, granzyme để tiêu diệt tế bào ung thư.
Giai đoạn equilibrium (cân bằng) là trạng thái "dormancy" khi hệ miễn dịch có thể kiểm soát nhưng không thể loại bỏ hoàn toàn tế bào ung thư. Quá trình này có thể kéo dài nhiều năm, thậm chí thập kỷ. Trong thời gian này, áp lực selection từ hệ miễn dịch thúc đẩy tế bào ung thư tiến hóa, tích lũy thêm các đột biến giúp chúng kháng lại tấn công miễn dịch. Interferon-γ từ T cell và NK cell đóng vai trò quan trọng trong việc duy trì trạng thái equilibrium này.
Giai đoạn escape (thoát khỏi) xảy ra khi tế bào ung thư phát triển được khả năng tránh hoặc ức chế hệ miễn dịch. Đây là giai đoạn nguy hiểm nhất trong cơ chế gây bệnh ung thư, khi khối u bắt đầu phát triển không kiểm soát và có khả năng di căn. Các cơ chế escape bao gồm: mất biểu hiện MHC class I, giảm biểu hiện tumor antigen, tăng biểu hiện immune checkpoint molecule và tạo ra tumor microenvironment immunosuppressive.
PD-1/PD-L1 checkpoint pathway là một trong những cơ chế immune evasion được nghiên cứu nhiều nhất. PD-1 (Programmed Death-1) được biểu hiện trên T cell được kích hoạt và các tế bào miễn dịch khác. PD-L1 (Programmed Death-Ligand 1) thường được tế bào ung thư biểu hiện quá mức để "ngụy trang" trước hệ miễn dịch. Khi PD-L1 liên kết với PD-1, tín hiệu ức chế được truyền đến T cell, dẫn đến T cell exhaustion và mất khả năng tiêu diệt tế bào ung thư.
CTLA-4 (Cytotoxic T-Lymphocyte Antigen-4) là immune checkpoint quan trọng khác, hoạt động ở giai đoạn sớm hơn của T cell activation. CTLA-4 cạnh tranh với CD28 để liên kết với B7 (CD80/CD86) trên antigen-presenting cell, tạo ra tín hiệu ức chế thay vì kích hoạt. Trong cơ chế gây bệnh ung thư, việc tăng biểu hiện CTLA-4 hoặc giảm biểu hiện CD28 có thể dẫn đến suy giảm đáp ứng miễn dịch chống khối u.
Regulatory T cell (Treg) đóng vai trò quan trọng trong việc tạo ra tumor microenvironment immunosuppressive. Tế bào Treg được tuyển dụng vào khối u thông qua chemokine như CCL22 và CCL17, sau đó tiết ra IL-10, TGF-β và các cytokine ức chế khác để tạo ra "sanctuary" bảo vệ tế bào ung thư khỏi tấn công miễn dịch. Myeloid-derived suppressor cell (MDSC) cũng tham gia vào quá trình này bằng cách ức chế chức năng của CD8+ T cell và NK cell.
Immunotherapy đã cách mạng hóa điều trị ung thư dựa trên hiểu biết sâu sắc về cơ chế gây bệnh ung thư và immune evasion. Checkpoint inhibitor như anti-PD-1 (nivolumab, pembrolizumab), anti-PD-L1 (atezolizumab, durvalumab) và anti-CTLA-4 (ipilimumab) đã cho thấy hiệu quả đáng kể trong điều trị nhiều loại ung thư. CAR-T cell therapy và adoptive T cell therapy đại diện cho thế hệ mới của immunotherapy, sử dụng tế bào miễn dịch được modify để tăng cường khả năng tiêu diệt tế bào ung thư.
Phương Pháp Phát Hiện Sớm Dựa Trên Hiểu Biết Cơ Chế
Biomarkers Ung Thư: Từ Cơ Chế Đến Ứng Dụng Lâm Sàng
Biomarkers ung thư là những chỉ số sinh học có thể đo được, phản ánh sự hiện diện và tiến triển của cơ chế gây bệnh ung thư trong cơ thể. Dựa trên hiểu biết sâu sắc về molecular mechanism của ung thư, các biomarker hiện đại không chỉ giúp phát hiện sớm mà còn cung cấp thông tin về giai đoạn bệnh, tiên lượng và đáp ứng điều trị.
Protein biomarkers truyền thống vẫn đóng vai trò quan trọng trong thực hành lâm sàng hiện tại. PSA (Prostate-Specific Antigen) được sử dụng rộng rãi trong tầm soát ung thư tuyến tiền liệt, với ngưỡng cảnh báo 4.0 ng/mL. Tuy nhiên, PSA có độ đặc hiệu không cao do cũng tăng trong viêm tuyến tiền liệt và phì đại tuyến tiền liệt lành tính. Các chỉ số cải tiến như PSA density (PSAD = PSA/thể tích tuyến tiền liệt) và free PSA/total PSA ratio giúp tăng độ chính xác chẩn đoán. Tỷ lệ free PSA/total PSA < 15% gợi ý nguy cơ cao ung thư tuyến tiền liệt.
CEA (Carcinoembryonic Antigen) là biomarker quan trọng cho ung thư đại trực tràng, với giá trị bình thường < 3.0 ng/mL ở người không hút thuốc và < 5.0 ng/mL ở người hút thuốc. CEA có giá trị chính trong theo dõi tái phát sau điều trị hơn là tầm soát sơ phát. Trong cơ chế gây bệnh ung thư đại trực tràng, CEA được tế bào ung thư tiết ra nhiều hơn do mất polarization và adhesion bình thường.
CA 19-9 (Carbohydrate Antigen 19-9) là biomarker đặc hiệu cho ung thư tuyến tụy, với ngưỡng chẩn đoán 37 U/mL. Tuy nhiên, 7-10% dân số thiếu enzyme fucosyltransferase không thể sản xuất CA 19-9, dẫn đến false negative. CA 19-9 cũng tăng trong một số bệnh lý lành tính như viêm tụy, xơ gan và tắc mật, làm giảm độ đặc hiệu.
Circulating tumor DNA (ctDNA) đại diện cho thế hệ biomarker mới, có độ nhạy và đặc hiệu cao hơn nhiều so với protein marker. ctDNA là các fragment DNA của tế bào ung thư được giải phóng vào máu khi tế bào chết. Công nghệ digital PCR và next-generation sequencing cho phép phát hiện ctDNA ở nồng độ rất thấp (0.01-0.1% tổng DNA tuần hoàn). Trong cơ chế gây bệnh ung thư, ctDNA mang thông tin di truyền đặc hiệu của khối u, bao gồm point mutation, copy number alteration và structural variant.
Một nghiên cứu gần đây trên 10.000 người khỏe mạnh sử dụng multi-cancer early detection test (GRAIL's Galleri test) cho thấy khả năng phát hiện 12 loại ung thư phổ biến với độ nhạy 51.5% và độ đặc hiệu 99.5%. Test này phân tích methylation pattern của ctDNA để không chỉ phát hiện sự hiện diện của ung thư mà còn dự đoán tissue of origin với độ chính xác 88.7%.
MicroRNA (miRNA) là nhóm biomarker triển vọng khác, có vai trò điều hòa biểu hiện gen ở cấp độ post-transcriptional. Trong cơ chế gây bệnh ung thư, pattern biểu hiện miRNA thay đổi đặc trưng ở từng loại ung thư. miR-21 tăng trong nhiều loại ung thư và hoạt động như oncomiR bằng cách ức chế tumor suppressor gene như PTEN và PDCD4. Ngược lại, let-7 family hoạt động như tumor suppressor miRNA, thường giảm trong ung thư phổi và có tương quan với tiên lượng xấu.
Tại Phòng Khám Đa Khoa Công Nghệ Cao Sài Gòn Medik, chúng tôi đã triển khai các xét nghiệm biomarker tiên tiến bao gồm liquid biopsy cho ctDNA analysis và multi-parameter protein panel. Với đội ngũ chuyên gia giàu kinh nghiệm từ các bệnh viện hàng đầu như Chợ Rẫy và Quân y 175, chúng tôi cung cấp dịch vụ tư vấn cá nhân hóa về lựa chọn biomarker phù hợp dựa trên yếu tố nguy cơ và tiền sử gia đình của từng bệnh nhân.
Liquid Biopsy - Công Nghệ Tầm Soát Thế Hệ Mới
Liquid biopsy đại diện cho paradigm shift trong phát hiện sớm ung thư, từ phương pháp xâm lấn truyền thống sang non-invasive testing chỉ cần một mẫu máu. Công nghệ này dựa trên hiểu biết về cơ chế gây bệnh ung thư ở cấp độ molecular, khai thác các "molecular fingerprint" mà tế bào ung thư để lại trong tuần hoàn.
Circulating tumor cells (CTCs) là tế bào ung thư đã tách khỏi khối u nguyên phát và di chuyển trong máu. Mặc dù cực kỳ hiếm (1-10 tế bào/mL máu so với 5 tỷ tế bào máu đỏ/mL), CTCs mang thông tin quan trọng về cơ chế gây bệnh ung thư và tiềm năng metastasis. Công nghệ CellSearch - được FDA phê duyệt đầu tiên cho CTCs detection - sử dụng immunomagnetic separation với kháng thể anti-EpCAM để bắt giữ tế bào biểu mô tuần hoàn.
Tuy nhiên, EpCAM-based capture có hạn chế do epithelial-mesenchymal transition (EMT) trong quá trình metastasis làm giảm biểu hiện EpCAM. Các công nghệ mới như CTC-Chip và Herringbone chip sử dụng microfluidics để bắt giữ CTCs dựa trên size và deformability, không phụ thuộc vào marker biểu hiện. Parsortix system sử dụng critical size filtering để tách CTCs (>6.5 μm) khỏi các tế bào máu nhỏ hơn.
Single-cell sequencing của CTCs cung cấp cái nhìn unique về heterogeneity của tế bào ung thư và evolution trong quá trình di căn. Nghiên cứu single-cell RNA sequencing trên CTCs từ bệnh nhân ung thư vú cho thấy existence của các subclone có signature gene expression khác nhau, phản ánh cơ chế gây bệnh ung thư đa dạng và khả năng adapt với môi trường tuần hoàn.
Cell-free DNA (cfDNA) analysis là component quan trọng nhất của liquid biopsy hiện tại. cfDNA bao gồm DNA từ tất cả các tế bào chết trong cơ thể, trong đó ctDNA chỉ chiếm 0.01-10% tùy thuộc vào giai đoạn và loại ung thư. Advanced sequencing technology như tagged-amplicon deep sequencing (TAm-Seq) và Safe-Sequencing System (Safe-SeqS) có thể phát hiện mutation với allele frequency thấp đến 0.01%.
Methylation-based liquid biopsy đang nổi lên như approach đầy triển vọng do methylation pattern ổn định hơn mutation và có tính đặc hiệu cao cho từng loại ung thư. Ví dụ, hypermethylation của SEPT9 gene promoter được FDA phê duyệt (Epi proColon test) cho tầm soát ung thư đại trực tràng với độ nhạy 68% và độ đặc hiệu 80%. GRAIL's Galleri test sử dụng genome-wide methylation analysis trên hơn 1 triệu CpG site để phát hiện và phân loại 50+ loại ung thư.
Fragmentomics - phân tích fragment size distribution của cfDNA - cung cấp thông tin bổ sung về tissue of origin. cfDNA từ các loại tế bào khác nhau có fragmentation pattern đặc trưng do sự khác biệt trong chromatin structure và nuclease activity. Machine learning algorithm có thể sử dụng fragmentomic feature để phân biệt cfDNA từ tế bào ung thư và tế bào bình thường với độ chính xác cao.
Liquid biopsy có nhiều ưu điểm so với tissue biopsy truyền thống: non-invasive, có thể lặp lại nhiều lần, phản ánh real-time tumor status và có thể detect minimal residual disease sau điều trị. Tuy nhiên, liquid biopsy cũng có những hạn chế: độ nhạy thấp hơn ở ung thư giai đoạn sớm, không cung cấp thông tin về tissue architecture và microenvironment, và chi phí hiện tại còn cao.
Lịch Trình Tầm Soát Dựa Trên Cơ Chế Phát Triển
Hiểu biết về cơ chế gây bệnh ung thư và natural history của từng loại ung thư cho phép thiết kế lịch trình tầm soát tối ưu, cân bằng giữa hiệu quả phát hiện sớm và minimizing overdiagnosis/overtreatment. Các guidelines hiện tại dựa trên extensive epidemiological data và randomized controlled trial để đưa ra khuyến cáo về tuổi bắt đầu, interval và phương pháp tầm soát.
Ung thư cổ tử cung có natural history được hiểu rõ nhất, từ nhiễm HPV đến cervical intraepithelial neoplasia (CIN) và cuối cùng là invasive cancer trong 10-20 năm. Pap smear có độ nhạy 55-85% trong phát hiện high-grade lesion, trong khi HPV testing có độ nhạy cao hơn (>95%) nhưng độ đặc hiệu thấp hơn do nhiễm HPV transient phổ biến ở phụ nữ trẻ. Current guideline khuyến cáo:
-
21-29 tuổi: Pap smear đơn độc mỗi 3 năm
-
30-65 tuổi: Co-testing (Pap + HPV) mỗi 5 năm hoặc HPV testing đơn độc mỗi 5 năm
-
>65 tuổi: Ngừng tầm soát nếu đã có kết quả âm tính liên tục
Ung thư vú có cơ chế gây bệnh ung thư phức tạp với multiple pathway và heterogeneity cao. Mammography có độ nhạy 85-90% ở phụ nữ >50 tuổi nhưng giảm xuống 65-80% ở phụ nữ trẻ do dense breast tissue. Digital breast tomosynthesis (3D mammography) cải thiện detection rate 1-2 per 1000 screenings và giảm recall rate 15-20%. MRI có độ nhạy cao nhất (>95%) nhưng chỉ được khuyến cáo cho phụ nữ high risk (BRCA mutation, lifetime risk >20-25%).
Risk-stratified screening đang được phát triển dựa trên polygenic risk score (PRS), breast density, hormonal factor và family history. Phụ nữ có PRS thuộc top 10% có nguy cơ ung thư vú gấp 2-3 lần so với population average, có thể cần bắt đầu tầm soát sớm hơn hoặc interval ngắn hơn.
Ung thư đại trực tràng phát triển từ adenomatous polyp trong 5-10 năm, cung cấp window of opportunity lý tưởng cho prevention thông qua polypectomy. Colonoscopy có độ nhạy cao nhất (>95% cho polyp >10mm) và có ưu điểm therapeutic intervention ngay trong khi screening. Tuy nhiên, procedure có tính xâm lấn và yêu cầu bowel preparation phức tạp.
FIT (Fecal Immunochemical Test) là alternative non-invasive với độ nhạy 70-80% cho colorectal cancer và 20-30% cho advanced adenoma. Multi-target stool DNA test (Cologuard) có độ nhạy cao hơn FIT (92% vs 74% cho cancer) nhưng độ đặc hiệu thấp hơn (87% vs 96%), dẫn đến false positive rate cao hơn.
CT colonography (virtual colonoscopy) có độ nhạy comparable với colonoscopy cho lesion >10mm nhưng giảm đáng kể cho lesion <6mm. Radiation exposure (5-7 mSv) và cost-effectiveness vẫn là concern cho widespread adoption.
Ung thư phổi có cơ chế gây bệnh ung thư liên quan mật thiết đến smoking history, tạo cơ sở cho risk-based screening. NLST (National Lung Screening Trial) và NELSON trial đã chứng minh low-dose CT (LDCT) giảm mortality 20-24% ở high-risk population. Current guideline khuyến cáo LDCT annually cho:
-
50-80 tuổi (updated từ 55-80)
-
≥20 pack-year smoking history
-
Current smoker hoặc quit <15 năm
AI-assisted lung nodule detection và characterization đang được integrate vào LDCT screening để giảm radiologist workload và improve consistency. Deep learning algorithm có thể achieve sensitivity >95% và specificity >90% trong phân biệt benign vs malignant nodule.
Tại Phòng Khám Đa Khoa Công Nghệ Cao Sài Gòn Medik, chúng tôi cung cấp dịch vụ tư vấn tầm soát ung thư cá nhân hóa dựa trên risk assessment toàn diện. Với trang thiết bị chẩn đoán hình ảnh hiện đại bao gồm CT 64 lát cắt, MRI 1.5T và hệ thống mammography kỹ thuật số, chúng tôi có thể thực hiện các xét nghiệm tầm soát chính xác và an toàn. Đội ngũ bác sĩ chuyên khoa ung bướu sẽ thiết kế lộ trình tầm soát phù hợp dựa trên tuổi, giới tính, tiền sử gia đình và các yếu tố nguy cơ cá thể của từng bệnh nhân.
Xu Hướng Nghiên Cứu và Điều Trị Tương Lai
Precision Medicine và Targeted Therapy
Precision medicine đại diện cho cuộc cách mạng trong điều trị ung thư, chuyển từ "one-size-fits-all" approach sang individualized therapy dựa trên molecular profile đặc trưng của từng khối u. Hiểu biết sâu sắc về cơ chế gây bệnh ung thư ở cấp độ genomic, transcriptomic và proteomic đã mở ra kỷ nguyên của targeted therapy với hiệu quả vượt trội so với chemotherapy truyền thống.
Genomic profiling đã trở thành standard of care trong điều trị nhiều loại ung thư. Next-generation sequencing (NGS) cho phép phân tích đồng thời hàng trăm gen liên quan đến ung thư với chi phí ngày càng giảm. FoundationOne CDx là comprehensive genomic profiling test được FDA phê duyệt, phân tích 324 gen và các biomarker quan trọng như microsatellite instability (MSI), tumor mutational burden (TMB) và homologous recombination deficiency (HRD) score.
Trong ung thư phổi non-small cell, việc phát hiện EGFR mutation đã cách mạng hóa điều trị. EGFR tyrosine kinase inhibitor như erlotinib, gefitinib và osimertinib cho thấy objective response rate 60-80% ở bệnh nhân có EGFR mutation so với chỉ 10-15% với chemotherapy. Đặc biệt, osimertinib (third-generation EGFR TKI) có khả năng vượt qua T790M resistance mutation và xuyên qua blood-brain barrier hiệu quả, cải thiện đáng kể overall survival.
ALK rearrangement xuất hiện trong 3-5% ung thư phổi non-small cell, chủ yếu ở bệnh nhân trẻ tuổi, không hút thuốc. ALK inhibitor như crizotinib, ceritinib và alectinib đã thay đổi hoàn toàn tiên lượng của nhóm bệnh nhân này. Alectinib có hiệu quả vượt trội so với crizotinib ở first-line setting với median progression-free survival 34.8 tháng so với 10.9 tháng.
ROS1 fusion được tìm thấy trong 1-2% ung thư phổi và có đáp ứng tốt với ROS1 inhibitor như crizotinib và entrectinib. NTRK fusion xuất hiện hiếm (0.2% ung thư phổi) nhưng có đáp ứng impressive với NTRK inhibitor như larotrectinib và entrectinib, với overall response rate >75% across multiple tumor type.
Trong cơ chế gây bệnh ung thư vú, HER2 amplification/overexpression xuất hiện trong 15-20% ca bệnh và có tiên lượng xấu trước khi có targeted therapy. Trastuzumab (Herceptin) là kháng thể monoclonal đầu tiên target HER2, cải thiện overall survival đáng kể khi kết hợp với chemotherapy. Pertuzumab (Perjeta) target domain khác của HER2 và có hiệu quả synergistic khi combine với trastuzumab. T-DM1 (trastuzumab emtansine) là antibody-drug conjugate deliver cytotoxic agent trực tiếp vào HER2-positive cell.
CDK4/6 inhibitor như palbociclib, ribociclib và abemaciclib đã cách mạng hóa điều trị ung thư vú hormone receptor-positive. Các thuốc này ức chế cyclin-dependent kinase 4 và 6, ngăn chặn progression từ G1 sang S phase trong cơ chế gày bệnh ung thư. Kết hợp CDK4/6 inhibitor với aromatase inhibitor cho median progression-free survival 24-28 tháng so với 14-16 tháng với aromatase inhibitor đơn độc.
PARP inhibitor exploit concept của synthetic lethality trong ung thư có BRCA mutation hoặc homologous recombination deficiency. Olaparib, rucaparib và niraparib đã được phê duyệt cho ung thư buồng trứng và vú có BRCA mutation. Ý tưởng synthetic lethality là tế bào ung thư thiếu một DNA repair pathway (homologous recombination) sẽ trở nên dependent vào pathway khác (base excision repair) để survival. PARP inhibitor ức chế base excision repair, dẫn đến double-strand break accumulation và cell death selective cho tế bào BRCA-deficient.
Artificial Intelligence Trong Nghiên Cứu Cơ Chế Ung Thư
Artificial Intelligence (AI) đang transforming nghiên cứu cơ chế gây bệnh ung thư ở multiple level, từ drug discovery, biomarker identification đến predictive modeling cho treatment outcome. Machine learning và deep learning algorithm có khả năng analyze massive dataset và identify pattern không thể detect bằng traditional method.
Trong drug discovery, AI dramatically accelerate quá trình identification và optimization của therapeutic compound. AlphaFold của DeepMind đã revolutionize protein structure prediction, cung cấp 3D structure cho >200 triệu protein với accuracy comparable với experimental method. Điều này có ý nghĩa quan trọng trong cơ chế gây bệnh ung thư vì hiểu được protein structure giúp thiết kế drug target specific hơn và predict drug-protein interaction.
Machine learning trong genomics giúp identify novel cancer driver gene và pathway. COSMIC (Catalogue of Somatic Mutations in Cancer) database chứa >6 triệu mutation từ >1.5 triệu tumor sample. AI algorithm có thể mine database này để identify mutation signature, predict functional impact của variant và classify driver vs passenger mutation. CanDL (Cancer Deep Learning) framework sử dụng deep neural network để predict cancer gene với accuracy >90%.
Biomarker discovery benefit significantly từ AI approach. Traditional method thường focus vào single biomarker, trong khi AI có thể identify multi-dimensional signature combining genomic, transcriptomic, proteomic và clinical data. Oncotype DX recurrence score cho ung thư vú sử dụng 21-gene expression assay để predict chemotherapy benefit. Decipher prostate cancer test analyze 22-gene signature để stratify risk và guide treatment decision.
Liquid biopsy analysis được enhance đáng kể bởi AI. GRAIL's Galleri test sử dụng machine learning algorithm để analyze methylation pattern của >100,000 genomic region, có thể detect 50+ cancer type với tissue-of-origin prediction accuracy 88.7%. Guardant360 ctDNA test combine mutation detection với AI-driven interpretation để provide actionable finding cho precision therapy.
Pathology image analysis là area có breakthrough significant nhất với AI application. Digital pathology kết hợp với convolutional neural network (CNN) có thể achieve diagnostic accuracy comparable hoặc superior so với expert pathologist. Google's Lymph Node Assistant có thể detect breast cancer metastasis trong lymph node với sensitivity 92.4% và specificity 99.3%. PathAI platform sử dụng AI để quantify tumor microenvironment feature như immune infiltration, có correlation mạnh với immunotherapy response.
Radiomics extract quantitative feature từ medical imaging data và combine với machine learning để predict clinical outcome. Radiomics signature có thể reflect underlying cơ chế gây bệnh ung thư như hypoxia, angiogenesis, immune infiltration mà không thể assess bằng conventional imaging. Trong ung thư phổi, CT radiomics có thể predict EGFR mutation status với accuracy >80%, giúp guide targeted therapy selection.
Kỳ Vọng Cho Tương Lai: 2025-2030
Giai đoạn 2025-2030 hứa hẹn những breakthrough revolutionary trong hiểu biết và điều trị cơ chế gây bệnh ung thư. Single-cell technology sẽ tiếp tục evolve với spatial resolution cao hơn, cho phép mapping chính xác cellular interaction trong tumor microenvironment. Spatial transcriptomics và spatial proteomics sẽ reveal complex crosstalk giữa cancer cell, immune cell, stromal cell và endothelial cell trong tumor ecosystem.
CRISPR gene editing technology expect sẽ move từ research tool sang clinical application. CRISPR 2.0 với enhanced specificity và reduced off-target effect sẽ enable precise genetic correction cho inherited cancer predisposition syndrome. Base editing và prime editing có thể correct point mutation mà không gây double-strand break, increase safety profile cho clinical use.
Immunotherapy sẽ tiếp tục expand với novel target và mechanism. Bi-specific antibody và tri-specific antibody có thể simultaneously target multiple antigen hoặc bring different cell type closer together. CAR-T cell therapy sẽ extend beyond hematologic malignancy sang solid tumor với improvement trong tumor trafficking, persistence và resistance to immunosuppressive microenvironment.
Tumor vaccination represent exciting frontier trong cancer prevention và treatment. Preventive vaccine cho high-risk individual (như BRCA carrier) có thể prevent cancer development bằng cách eliminate pre-cancerous cell. Therapeutic vaccine customize dựa trên individual tumor neoantigen có thể boost immune response against established cancer.

Early detection technology sẽ achieve unprecedented sensitivity với multi-modal approach combining ctDNA, protein biomarker, metabolite và imaging signature. Wearable device có thể continuously monitor physiological parameter và detect cancer-related change trong real-time. Integration với AI sẽ enable predictive model forecast cancer risk nhiều năm trước khi clinical symptom appear.
Tại Phòng Khám Đa Khoa Công Nghệ Cao Sài Gòn Medik, chúng tôi cam kết luôn cập nhật những tiến bộ mới nhất trong nghiên cứu cơ chế gây bệnh ung thư và ứng dụng vào thực hành lâm sàng. Với network collaboration với các trung tâm y tế hàng đầu trong và ngoài nước, chúng tôi mang đến cho bệnh nhân Việt Nam access đến những breakthrough therapy và diagnostic technology tiên tiến nhất. Đội ngũ chuyên gia của chúng tôi sẽ tư vấn và đồng hành cùng bệnh nhân trong hành trình chống lại căn bệnh ung thư, từ phòng ngừa, phát hiện sớm đến điều trị cá nhân hóa dựa trên hiểu biết khoa học vững chắc về cơ chế bệnh sinh.
Hiểu rõ cơ chế gây bệnh ung thư không chỉ mang ý nghĩa học thuật mà còn có tác động thiết thực trong cuộc sống hàng ngày. Kiến thức này giúp chúng ta đưa ra những quyết định sáng suốt về lối sống, chế độ ăn uống và tầm soát định kỳ. Với sự phát triển không ngừng của khoa học y học, hy vọng về việc chiến thắng căn bệnh ung thư ngày càng trở nên khả thi.
Liên hệ hotline 1900 5175 để được tư vấn chi tiết về các gói tầm soát và phòng ngừa ung thư phù hợp với từng cá nhân tại Phòng Khám Đa Khoa Công Nghệ Cao Sài Gòn Medik.